Willkommen bei Target-H – Gemeinsam gegen Hautkrebs



Die Zahl der Hautkrebserkrankungen steigt weltweit kontinuierlich und stellt die dermatologische Forschung vor erhebliche Herausforderungen. Das Verbundprojekt Target-H, koordiniert durch die Universitätsmedizin Rostock und unterstützt von der Exzellenzinitiative Mecklenburg-Vorpommern mit insgesamt fünf Millionen Euro, begegnet diesen Herausforderungen mit hochinnovativen und interdisziplinären Ansätzen.
Ein wesentlicher Bestandteil des Projekts Target-H ist die Entwicklung und klinische Validierung modernster bildgebender Verfahren, die eine präzise, schnelle und patientenschonende Hautkrebsdiagnostik ermöglichen sollen. Diese innovativen Methoden sollen es erstmals erlauben, Tumordignität und Tumordicke in einem einzelnen, kombinierten Verfahren verlässlich und ohne invasive Eingriffe festzustellen. Neben optischer Kohärenztomographie (OCT), Optoakustik (OA), Raman-Spektroskopie (RS) und hochauflösendem Ultraschall (HUS) kommt zusätzlich hyperspektrale Bildgebung zum Einsatz, welche detaillierte Informationen über Gewebedurchblutung, Sauerstoffversorgung und Melaninverteilung liefert. Alle erhobenen Daten werden mithilfe künstlicher Intelligenz (KI) ausgewertet, um Diagnosen automatisiert, exakt und reproduzierbar zu erstellen – und so Fehlbehandlungen drastisch zu reduzieren und die Lebensqualität der Patienten erheblich zu verbessern.
Neben der Diagnostik widmet sich Target-H auch der Entwicklung einer optimierten Kaltplasma-Technologie für die effektive Behandlung von Hautkrebs. Kaltplasma ist ein ionisiertes Gas, das reaktive Sauerstoff- und Stickstoffspezies erzeugt, welche selektiv Krebszellen angreifen, ohne gesundes Gewebe nennenswert zu schädigen. Ziel ist die Etablierung einer sicheren und hochwirksamen Kombination mit bestehenden Therapien wie der Immuncheckpointinhibition.
Auch die Personalisierte Medizin ist ein zentraler Bestandteil des Verbundprojektes. Die molekulare Analyse von Tumoren ermöglicht die Identifikation spezifischer Muster, welche entscheidend für den Therapieerfolg sind. Hierfür setzt das Projekt hochmoderne Transkriptom-Technologien ein, um detaillierte molekulare Profile sowohl unter normalen als auch hypoxischen Bedingungen zu erstellen, um durch diese Informationen eine individuell zugeschnittene und somit hocheffektive Therapie zu ermöglichen.
Um die Komplexität dieser modernen Diagnostik- und Therapieansätze optimal zu nutzen, entwickelt Target-H darüber hinaus ein innovatives klinisches Entscheidungsunterstützungssystem (CDSS). Dieses System integriert alle erhobenen diagnostischen und molekularen Daten und nutzt fortschrittliche Algorithmen, um Ärztinnen und Ärzten eine klare und nachvollziehbare Therapieempfehlung zu geben, aus der eine optimale und individuelle Patientenversorgung realisiert werden kann.
Das Projekt baut auf dem Erfolg des Vorgängers ONKOTHER-H auf, einem von 2017 bis 2022 mit fast drei Millionen Euro geförderten Forschungsverbund, der sich der Etablierung einer translationalen Entwicklungsplattform für neuartige Krebstherapien verschrieben hatte, auf die Target-H nun aufsetzt.
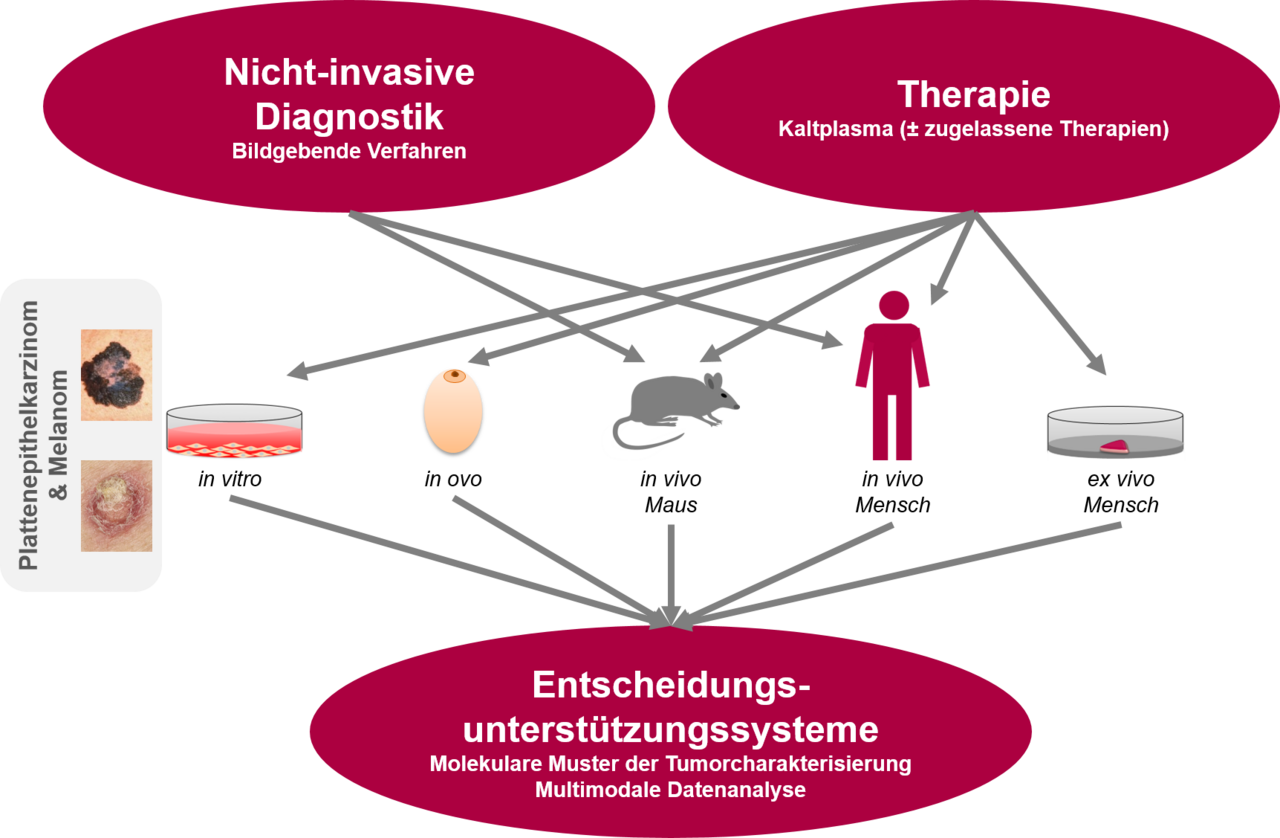
Acht Teilprojekte – ein Ziel: Ein starkes Konsortium für interdisziplinäre Spitzenforschung
Das Konsortium von Target-H umfasst führende Forschungseinrichtungen und Universitätskliniken aus Mecklenburg-Vorpommern und Niedersachsen, darunter die Universitätskliniken Rostock (UMR) und Greifswald (UMG), die Hochschule Wismar, das Leibniz-Institut für Plasmaforschung und Technologie (INP Greifswald), das Fraunhofer-Institut für Graphische Datenverarbeitung (IGD Rostock) sowie das Hannoversche Zentrum für Optische Technologien (HOT).
Unter der Leitung von Prof. Emmert und Dr. Böckmann (Dermatologie, UMR) und in Zusammenarbeit mit Prof. Roth als assoziiertem Partner vom HOT Hannover wird eine multimodale, nicht-invasive Diagnostikplattform auf Basis von optischer Kohärenztomographie, Optoakustik, Ultraschall und Raman-Spektroskopie entwickelt und getestet.
Prof. Hinz (Pharmakologie, UMR) analysiert mit seinem Team die Wirkung von Kaltplasma und zielgerichteten Medikamenten auf Melanom- und Plattenepithelkarzinom-Zellen unter normoxischen und hypoxischen Bedingungen.
Am INP Greifswald arbeitet man unter Federführung von Prof. Bekeschus an der Entwicklung innovativer Kaltplasmaquellen und 3D-Hautkrebsmodellen, die für realitätsnahe Tests optimiert sind, um molekulare Wirkmechanismen aufzuklären.
Von der Hochschule Wismar aus, geleitet von Prof. Hornberger, wird die hyperspektrale Bildgebung für die Diagnostik kleiner Hautareale weiterentwickelt. Die erfassten Daten werden KI-basiert ausgewertet, um tumorspezifische Signaturen zu identifizieren und den Therapieverlauf zu überwachen.
Das KI-gestützte, klinische Entscheidungsunterstützungssystem (CDSS) stammt von den Spezialisten des Fraunhofer IGD (Rostock) unter der Leitung von Dr. Aehnelt. Es integriert die im Verbund gesammelten Daten, um Hautkrebsarten zu erkennen, deren Verlauf zu analysieren und Therapieentscheidungen zu unterstützen.
An der Universitätsmedizin Greifswald fokussiert das Team um Frau Prof. Radke auf räumliche Transkriptomanalysen mit dem Ziel, therapieassoziierte molekulare Veränderungen und die Tumorheterogenität auf Einzelzellebene zu erfassen und neue Marker für das Plattenepithelkarzinom (PEK) und Melanom (MM) zu identifizieren.
Frau Prof. Vollmar vom Rudolf-Zenker-Institut für Experimentelle Chirurgie (UMR) untersucht in Mausmodellen die Wirkung reaktiver Spezies aus Kaltplasma auf das Tumorwachstum, um durch bildgebende Verfahren und molekularbiologische Analysen dazu beizutragen, die therapeutischen Wirkmechanismen weiter aufzuklären.
Die AG um PD Dr. Murua Escobar (Medizinische Genetik, UMR) analysiert mit Hochdurchsatzsequenzierungen die molekularen Signaturen von Hauttumorzellen nach der Plasmabehandlung. Das Ziel ist es, zelluläre Reaktionen auf DNA-, RNA- und Proteinebene zu verstehen.
Smarte Diagnostik
Hautkrebs zählt zu den häufigsten malignen Erkrankungen weltweit, wobei sowohl das kutane Melanom (MM) als auch die nicht-melanozytären Formen – das Basalzellkarzinom (BCC) und das Plattenepithelkarzinom (PEK) – eine stetig steigende Inzidenz aufweisen [1, 2]. Während das MM als die aggressivste Variante gilt und bereits frühzeitig zur Metastasierung neigt, dominieren BCC und PEK zahlenmäßig die tägliche Praxis der Dermatologie.
Zur Früherkennung von Hauttumoren wurde in Deutschland das Hautkrebsscreening ab dem 35. Lebensjahr etabliert, das von den gesetzlichen Krankenkassen getragen wird. Trotz dieses wichtigen Instruments zur Sekundärprävention ist die diagnostische Treffsicherheit im klinischen Alltag nach wie vor eine Herausforderung: Nur etwa 5–10 % der im Rahmen des Screenings entnommenen Gewebeproben erweisen sich histologisch als maligne [3]. Die diagnostische Sensitivität ist somit hoch – jedoch zulasten der Spezifität.
Insbesondere bei geringer klinischer Erfahrung kann dies bedeuten, dass zahlreiche gutartige Hautveränderungen exzidiert werden müssen, um eine einzelne maligne Läsion sicher zu erfassen – im Extremfall bis zu 58 Exzisionen je bestätigtem Karzinom [3]. Diese Praxis bringt nicht nur körperliche Belastungen wie Wundschmerz, Narbenbildung oder Komplikationen mit sich, sondern erzeugt auch psychischen Stress bei den Patientinnen und Patienten. Der bloße Verdacht auf Hautkrebs kann erhebliche Ängste auslösen („Burden of Cancer“), auch wenn sich dieser später als unbegründet herausstellt.
Vor diesem Hintergrund besteht ein erheblicher Bedarf an innovativen diagnostischen Verfahren, die es erlauben, schnell, zuverlässig und vor allem nicht-invasiv zwischen benignen und malignen Hautveränderungen zu differenzieren – und damit unnötige Biopsien zu vermeiden, die Patientenbelastung zu reduzieren und die Effizienz dermatologischer Versorgung nachhaltig zu steigern.
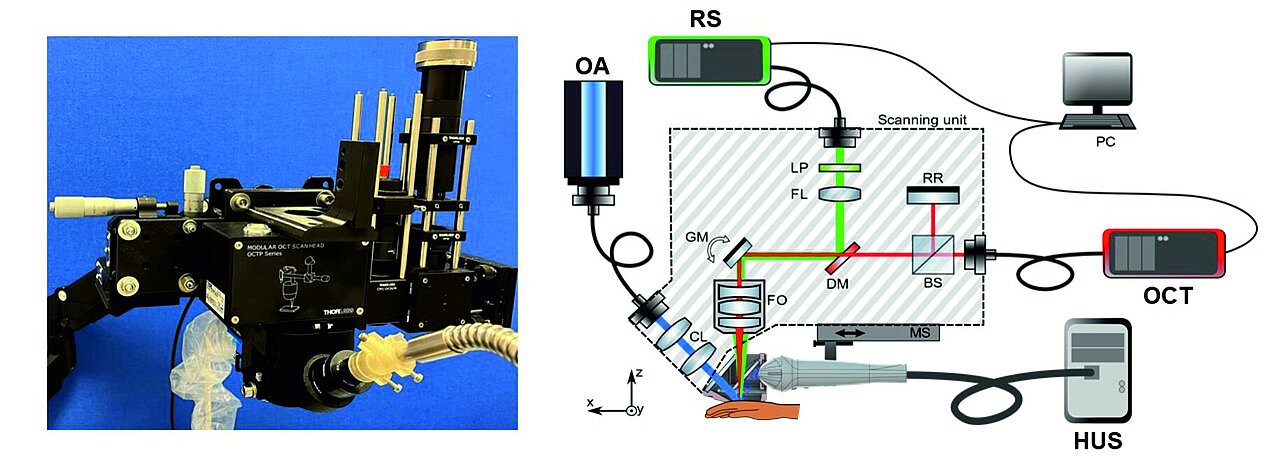
In den vergangenen Jahren rückten daher optische Verfahren verstärkt in den Fokus der Forschung. Die optische Kohärenztomographie (OCT) zeigt dabei vielversprechende Ergebnisse, allerdings – wegen der limitierten Eindringtiefe – nur für Tumore unter einer Dicke von 1,5 mm. Der bislang optisch „blinde“ Tiefenbereich kann nur durch optoakustische Bildgebung (OA) erschlossen werden, bei der die Umwandlung von Licht in Ultraschall genutzt wird, um eine tiefenauflösende Darstellung von Gewebestrukturen zu ermöglichen [4–10].
Weiterhin finden auch spektroskopische Verfahren wie die Ramanspektroskopie (RS) zunehmend Beachtung, die durch Analyse molekularer Schwingungsspektren eine chemische Charakterisierung von Gewebe – und somit die Detektion von Tumoren – ermöglichen [11]. Allerdings mangelt es bislang an In-vivo-Studien, die die gesetzlichen Grenzwerte für Strahlenexposition strikt einhalten – ein entscheidendes Kriterium für den klinischen Einsatz.
Da die genannten Einzelverfahren bislang nicht ausreichen, um sowohl Tumordignität als auch Tumordicke präzise und verlässlich zu bestimmen, bleibt eine valide, nicht-invasive Diagnostik des Hautkrebses eine ungelöste Herausforderung.
Genau hier setzt das Verbundvorhaben Target-H an: Es verfolgt das Ziel, verschiedene hochinnovative bildgebende Technologien – darunter optoakustische Verfahren, Raman-Spektroskopie, optische Kohärenztomographie und hochauflösenden Ultraschall – in einer einzigen Messeinheit zu kombinieren, das physiologische und biochemische Gewebemerkmale visuell differenzierbar macht.
Im Rahmen eines vorangegangenen DFG-Projekts war es den Teams um Prof. Emmert und Prof. Roth erstmals gelungen, eine verlässliche Tumordickenbestimmung beim MM in nur einem Messvorgang zu realisieren – bei gleichzeitiger Einhaltung der gesetzlich zulässigen Expositionsgrenzwerte für die Haut – wofür die Forscher mit dem renommierten Helmholtz-Preis 2024 ausgezeichnet wurden.
In Target-H wird dieses Diagnosesystem nun gezielt für die Anwendung beim MM und PEK weiterentwickelt und durch ein zweites System (Prof. Hornberger) zur nicht-invasiven Diagnostik auf Basis hyperspektraler Bildgebung ergänzt, einer Technik, die die Erfassung von Gewebsmerkmalen wie Sauerstoffsättigung, Durchblutung, Wasser- und Melaningehalt ermöglicht. Aus der Kombination der Messdaten erfolgt mittels KI-basierter Lernalgorithmen eine automatisierte, robuste und erklärbare Klassifikation der Läsionen, die durch ergänzende molekulare Charakterisierungen (insbesondere Transkriptomanalysen) in ihrer diagnostischen Aussagekraft weiter gestärkt werden (s. u.). Gleichzeitig erfolgt eine klinische Evaluierung anhand des Goldstandards, d. h. einer korrelativen Analyse anhand histopathologischer Befunde.
Alle erhobenen Daten fließen gleichzeitig in ein klinisches Entscheidungsunterstützungssystem ein (s. u.), sodass eine umfassende digitale Plattform entsteht, die Bildgebung, molekulare Information und klinische Kontextdaten zusammenführt und behandelnden Dermatolog:innen eine evidenzbasierte Entscheidungshilfe anbieten wird.

Innovative Therapien
Die im Projekt Target-H geplante Weiterentwicklung und Optimierung spezifischer Plasmaquellen für die Tumorbehandlung baut auf den Vorerfahrungen von ONKOTHER-H auf, ein ebenfalls von der Exzellenzinitiative MV aus ESF-Mitteln (EU) gefördertes Verbundprojekt (Fördersumme 2,7 Millionen, 2018–2022). Dabei sollen unter der Leitung von Prof. Bekeschus vom INP neue Systeme mit einer stärkeren antitumoralen Wirkung bei gleichzeitig kürzerer Behandlungszeit für die gezielte, oberflächliche Applikation auf Hauttumoren entworfen, getestet und klinisch evaluiert werden.
Dies soll durch gezielte Anpassung der technischen Parameter – wie Gaszusammensetzung, Spannung, Frequenz oder Düsengeometrie – gelingen, die die Zusammensetzung der erzeugten Plasmakomponenten, insbesondere die Konzentration reaktiver Sauerstoff- und Stickstoffspezies (RONS), beeinflussen. Die geplante Entwicklung umfasst den Bau eines funktionsfähigen Labormusters und dessen physikochemische Charakterisierung auf Grundlage der DIN-Normen (SPEC 91315). Parallel erfolgt eine umfassende biologische Testung in verschiedenen Modellsystemen: von 2D-Zellkulturen (Prof. Hinz) über 3D-Organoide im bebrüteten Hühnerembryo (Prof. Bekeschus) bis zu Mausmodellen (Prof. Vollmar). Die molekularen Wirkmechanismen der Kaltplasmaanwendung werden u. a. mittels RNA-Sequenzierung (PD Dr. Murua Escobar) und unter hypoxischen Bedingungen (Prof. Hinz) untersucht, um relevante Signalwege und Resistenzen zu identifizieren. Die Auswirkungen der Behandlung auf gesundes Gewebe und Tumorgewebe werden zusätzlich durch bildgebende Verfahren evaluiert (Prof. Emmert, Prof. Hornberger). Durch die enge Verzahnung mit spektroskopischen Diagnostikverfahren entsteht ein integrierter Analyseansatz, der Therapieeffekte bildgebend sichtbar macht und zugleich neue Wege der Hautkrebstherapie eröffnet.
Prädiktive Signalmuster zur Tumorcharakterisierung
Ein drittes Forschungsfeld des Verbundprojektes trägt dem Umstand Rechnung, dass die Wirksamkeit moderner Krebstherapien eng mit der molekularen Signatur des individuellen Tumors verknüpft ist – was insbesondere in der Dermatologie zunehmend an klinischer Relevanz gewinnt. So erlaubt etwa die Überexpression des epidermalen Wachstumsfaktorrezeptors EGFR beim PEK den gezielten Einsatz monoklonaler Antikörper wie Cetuximab. Beim MM stellt die BRAF-V600E-Mutation eine therapeutisch angreifbare Schwachstelle dar, die mit Small Molecules wie Dabrafenib (BRAF-Inhibitor) und Trametinib (MEK-Inhibitor) gezielt adressiert werden kann. Diese zielgerichteten Therapien, oft in Kombination mit Immuncheckpointinhibitoren, haben die Melanomtherapie revolutioniert. Dennoch bleiben viele Tumoren refraktär oder entwickeln im Therapieverlauf Resistenzen – ein Hinweis auf die hohe biologische Komplexität und Heterogenität solider Tumoren.
Ein bedeutender Einflussfaktor auf Therapieansprechen und Resistenz ist die intratumorale Hypoxie, ein weitverbreitetes Merkmal maligner Hauttumoren. Der Hypoxie-induzierbare Faktor 1α (HIF-1α) spielt hierbei eine zentrale Rolle, weswegen zwei Teilprojekte aus der Pharmakologie und der Medizinischer Genetik der Universitätsmedizin Rostock die Wirkung einer Kaltplasmabehandlung unter hypoxischen Bedingungen untersuchen.
Zur molekularen Charakterisierung dienen umfassende Transkriptomanalysen (PD Dr. Murua Escobar), mit dem Ziel, differenziell exprimierte Gene und Signalnetzwerke unter verschiedenen Therapiebedingungen zu identifizieren. Ein weiteres Ziel ist die Untersuchung der intratumoralen Heterogenität, da die genetische und epigenetische Vielfalt innerhalb eines Tumors einen entscheidenden Faktor für Therapieversagen darstellt [18, 19]. Frau Prof. Radke von der Pathologie der UMG verantwortet dabei die Implementierung der räumlichen Transkriptomik, mit Fokus auf die Charakterisierung von Subklon-Dynamiken vor und nach Kaltplasma-Therapien, sowie die immunhistochemische Validierung von interessanten Kandidatenmolekülen aus der Transkriptomanalyse. Die resultierenden Daten werden ebenfalls für die Entwicklung des KI-gestützten Diagnosesystems genutzt.
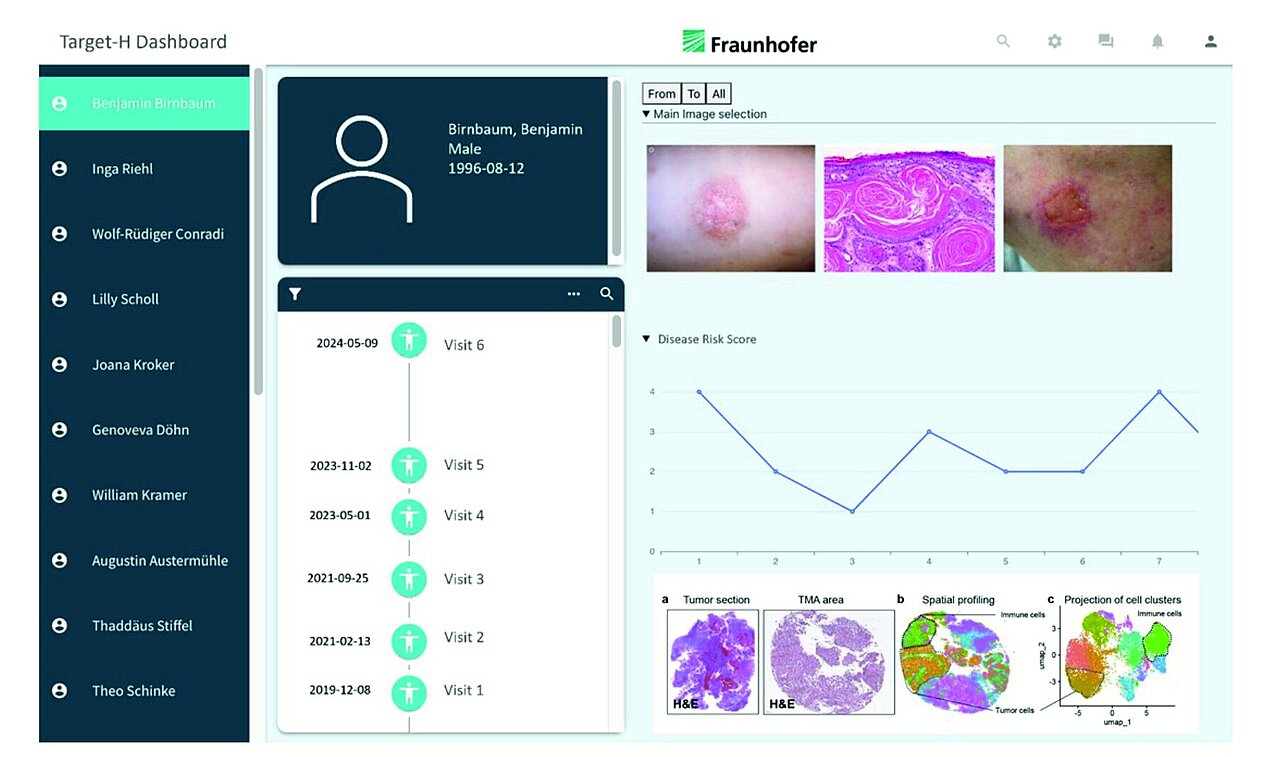
Entwicklung eines klinischen Entscheidungsunterstützungssystems für die Diagnostik und Therapie von Hautkrebs
Alle Daten und Analysen der ersten sieben Verbundpartner laufen schließlich beim achten Partner, dem Fraunhofer-Institut, zusammen. Unter der Leitung von Dr. Aehnelt entsteht dort durch die Integration und Fusion multipler bildgebender und molekularbiologischer Datensätze mittels Methoden der künstlichen Intelligenz das dritte Anliegen von Target-H: Die Entwicklung eines fundierten, evidenzbasierten Unterstützungstools für Diagnostik und Therapieentscheidungen bei Hautkrebs.
Dieses klinische Entscheidungsunterstützungssystem (CDSS) soll Ärztinnen und Ärzten helfen, auf Basis hochdimensionaler Informationen – etwa aus der hochauflösenden Dermatoskopie, Histopathologie, optischer Kohärenztomographie (OCT), Optoakustik (OA), Raman-Spektroskopie (RS), hochauflösendem Ultraschall (HUS), Hyperspektralbildgebung und räumlicher Transkriptomik – strukturierte, reproduzierbare Diagnosen zu stellen. Ziel ist es, Inter- und Intraobserver-Variabilität zu reduzieren, die Treffsicherheit bei der Bestimmung von Dignität und Tumordicke zu erhöhen sowie Therapieentscheidungen patientenindividuell und datengestützt vorzubereiten.
Ein besonderes Potenzial liegt dabei in der Möglichkeit, sogenannte Omics-Merkmale (z. B. Genexpressionsmuster oder molekulare Signaturen) indirekt aus Bilddaten zu prädizieren. Dies kann helfen, submikroskopische pathologische Veränderungen frühzeitig zu erfassen, noch bevor sie histologisch sichtbar werden – ein möglicher Meilenstein für die Frühdiagnostik in der Dermatologie.
Langfristig soll das CDSS zu einer höheren diagnostischen Präzision, einer verbesserten Therapieplanung und einer personalisierten Nachsorge in der dermatologischen Onkologie beitragen. Überdies eröffnet die entwickelte Technologie neue Perspektiven für weitere medizinische Anwendungsgebiete und leistet einen nachhaltigen Beitrag zur klinischen Etablierung KI-basierter Verfahren im Sinne einer modernen, präzisionsmedizinisch ausgerichteten Patientenversorgung.
Fazit und Ausblick
Das Forschungsprojekt Target-H verspricht erhebliche Fortschritte für die onkologische Dermatologie und könnte einen wichtigen Beitrag für eine verbesserte Patientenversorgung leisten. Ebenso eröffnet die einzigartige Kombination aus intelligenter Diagnostik, innovativer Plasmatherapie und personalisierter Tumorcharakterisierung herausragende Chancen, um Mecklenburg-Vorpommern als Innovationsstandort im Gesundheitsbereich weiter zu stärken.
Daneben fördert Target-H aktiv den Wissenstransfer und die Wissenschaftskommunikation durch regelmäßige Veröffentlichungen, öffentliche Veranstaltungen und Fortbildungen für medizinisches Fachpersonal, in dem auch Fragen der Ethik und Technikfolgenabschätzung von KI-Anwendungen im Gesundheitssystem ein integraler Bestandteil sind.
Förderung
Das Projekt Target-H wird im Rahmen des EFRE Programms 2021 bis 2027 des Landes Mecklenburg-Vorpommern aus Mitteln des Europäischen Fonds für regionale Entwicklung der Europäischen Union gefördert.
Literatur
Literatur
1 Bray F, Laversanne M, Sung H et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA: a cancer journal for clinicians 2024; 74: 229 – 263
2 Robert Koch Institut. Krebs in Deutschland – 2019/2020 2023
3 Haenssle HA, Fink C, Toberer F et al. Man against machine reloaded: performance of a market-approved convolutional neural network in classifying a broad spectrum of skin lesions in comparison with 96 dermatologists working under less artificial conditions. Annals of oncology : official journal of the European Society for Medical Oncology 2020; 31: 137 – 143
4 Shao Q, Morgounova E, Jiang C et al. In vivo photoacoustic lifetime imaging of tumor hypoxia in small animals. Journal of Biomedical Optics 2013; 18: 76019
5 Qi W, Jin T, Rong J et al. Inverted multiscale optical resolution photoacoustic microscopy. Journal of biophotonics 2017; 10: 1580 – 1585
6 Zhang HF, Maslov K, Stoica G et al. Functional photoacoustic microscopy for high-resolution and noninvasive in vivo imaging. Nature biotechnology 2006; 24: 848 – 851
7 Wang H, Tsai T-H, Zhao J et al. Differentiation of HaCaT cell and melanocyte from their malignant counterparts using micro-Raman spectroscopy guided by confocal aging. Photodermatology, photoimmunology & photomedicine 2012; 28: 147 – 152
8 Favazza CP, Jassim O, Cornelius LA et al. In vivo photoacoustic microscopy of human cutaneous microvasculature and a nevus. Journal of Biomedical Optics 2011; 16: 16015
9 Razansky D, Buehler A, Ntziachristos V. Volumetric real-time multispectral optoacoustic tomography of biomarkers. Nature protocols 2011; 6: 1121 – 1129
10 Manohar S, Vaartjes SE, van Hespen JCG et al. Initial results of in vivo non-invasive cancer imaging in the human breast using near-infrared photoacoustics. Optics express 2007; 15: 12277 – 12285
11 Malvehy J, Hauschild A, Curiel-Lewandrowski C et al. Clinical performance of the Nevisense system in cutaneous melanoma detection: an international, multicentre, prospective and blinded clinical trial on efficacy and safety. The British journal of dermatology 2014; 171: 1099 – 1107
12 Boeckmann L, Schäfer M, Bernhardt T et al. Cold Atmospheric Pressure Plasma in Wound Healing and Cancer Treatment. Applied Sciences 2020; 10: 6898
13 Dubuc A, Monsarrat P, Virard F et al. Use of cold-atmospheric plasma in oncology: a concise systematic review. Therapeutic advances in medical oncology 2018; 10: 1758835918786475
14 Hirst AM, Frame FM, Arya M et al. Low temperature plasmas as emerging cancer therapeutics: the state of play and thoughts for the future. Tumour biology : the journal of the International Society for Oncodevelopmental Biology and Medicine 2016; 37: 7021 – 7031
15 Keidar M. Plasma for cancer treatment. Plasma Sources Science and Technology 2015; 24: 33001
16 Boeckmann L, Berner J, Kordt M et al. Synergistic effect of cold gas plasma and experimental drug exposure exhibits skin cancer toxicity in vitro and in vivo. Journal of advanced research 2023
17 Canady J, Murthy SRK, Zhuang T et al. The First Cold Atmospheric Plasma Phase I Clinical Trial for the Treatment of Advanced Solid Tumors: A Novel Treatment Arm for Cancer. Cancers 2023; 15
18 Crucitta S, Cucchiara F, Mathijssen R et al. Treatment-driven tumour heterogeneity and drug resistance: Lessons from solid tumours. Cancer treatment reviews 2022; 104: 102340
19 Redmer T, Schumann E, Peters K et al. MET receptor serves as a promising target in melanoma brain metastases. Acta neuropathologica 2024; 147: 44
